Sumario:
En el post anterior te decía que necesitaba hacer un paréntesis para terminar el repaso a los orgánulos de la célula. Te contaba que Beadle y Tatum se habían dado cuenta que en el ADN del moho que utilizaban en sus experimentos estaban almacenadas las instrucciones para construir las proteínas. Yendo un poco más allá, […]
En el post anterior te decía que necesitaba hacer un paréntesis para terminar el repaso a los orgánulos de la célula. Te contaba que Beadle y Tatum se habían dado cuenta que en el ADN del moho que utilizaban en sus experimentos estaban almacenadas las instrucciones para construir las proteínas. Yendo un poco más allá, resulta que los genes codifican las proteínas, pero, si esto es así, ¿quién las sintetiza?, ¿qué orgánulo es el encargado de unir los aminoácidos que forman una proteína?
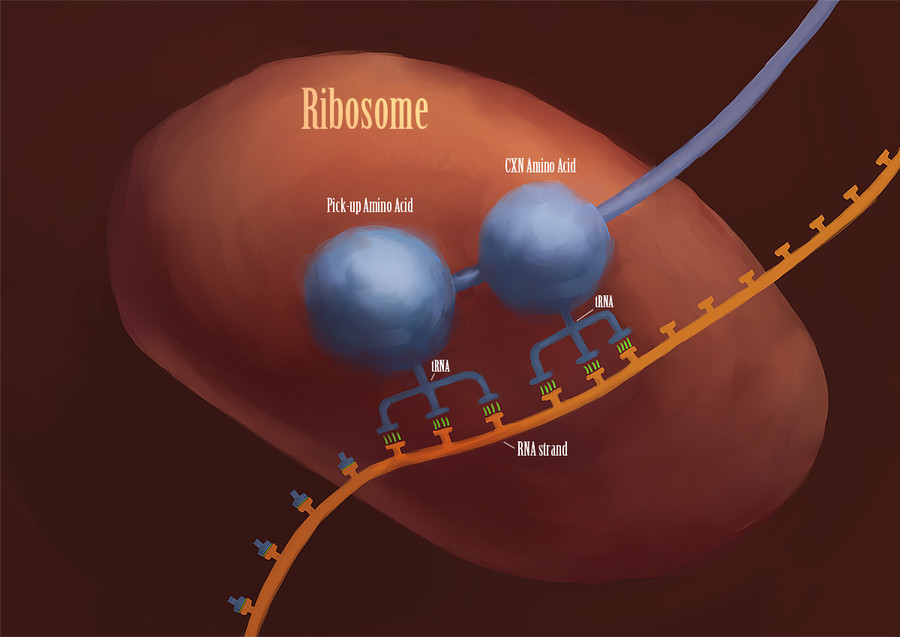
Seguro que ya lo sabías, se trata de los ribosomas, pequeñas estructuras formadas por macromoléculas de ARN (ácido ribonucleico) y proteínas que se encuentran en el citoplasma, en el retículo endoplásmico o en mitocondrias y cloroplastos. Y son tremendamente importantes ya que su misión es, insisto, sintetizar las proteínas.
Las proteínas son cadenas de aminoácidos, pero no te imagines una cadena de individuos bailando “la conga de jalisco” como en la boda de tu primo. Ya entiendo que aquello fue portentoso pero, por muy ágil que sea tu cuñao, lo de las proteínas va más allá. La cadena tiene que encajar miles de aminoácidos en número y orden correctos y, por si eso fuera poco, después debe retorcerse (en palabras de Faemino y Cansado) como “si no hubiera dios”. Y a eso se le llama plegarse, pero no tiene casi nada que ver con lo que haces con la ropa que sacas de la secadora. Los aminoácidos de una proteínas establecen entre ellos puentes de hidrógeno y enlaces de otros tipos, lo que les permite tener estructura tridimensional. Predecir la forma tridimensional de las proteínas es un problema todavía sin resolver. Además, cualquier variación en esa estructura puede implicar la pérdida de funcionalidad o que una proteína deje de ser metabolizable. Si este plegamiento anómalo es además «contagiable» por contacto, como en el caso de los priones, puede convertirse en un problema de salud preocupante. Tan preocupante como el de la la encefalopatía espongiforme bovina, o enfermedad de las vacas locas.
Aun así, puede que no te parezcan gran cosa, pero las proteínas tienen una importancia enorme para ti. Te pondré algún ejemplo de los quehaceres que suelen tener tus proteínas:
- Los filamentos de actina que permiten que tus músculos se contraigan o que tus células mantengan su forma, el citoesqueleto, están compuestos por grupos de proteínas.
- La inmunoglobulina es una proteína y también es un anticuerpo, o sea, los buenos de la peli, y créeme cuando te digo que te conviene que tus ribosomas sean capaces de producir las proteínas de tus anticuerpos con cierta alegría.
- La fenilalanina hidroxilasa es un enzima que permite transformar un aminoácido (fenilalanina) en otro (tirosina); la fenilcetonuria es una enfermedad congénita bastante grave, producida por la carencia de esta enzima, aunque afortunadamente el patrón de herencia es recesivo.
- La ferritina es la principal responsable del almacenamiento de hierro en los vertebrados, es un polipéptido, es decir, la unión de varias proteínas, y si no produces la suficiente, tendrás anemia.
- O, por terminar alguna vez, la hormona del crecimiento, que es también una proteína que es producida en las células de tu hipófisis y regula el crecimiento celular.
[youtube https://www.youtube.com/watch?v=qBRFIMcxZNM]
¿Qué haríamos sin proteínas? Pienso que nada.
En este punto, hemos llegado al terreno de los mensajeros químicos: hormonas, neurotransmisores, feromonas… que son los que cortan el bacalao en tu organismo. Ahí se hace lo que ellos dicen. Estos tipos contienen proteínas, cuando no están formados íntegramente por ellas. Ordenan que las células se dividan, que se alarguen los telómeros (telomerasa), fomentan la angiogénesis (Factor de crecimiento endotelial vascular, VEGF)… Pero un gran poder conlleva una gran responsabilidad. Y el responsable de todo este tinglado es el ADN. Verás como lo hace.
Según dice el “Dogma central de la biología”, cada gen codifica una proteína. Siguiendo la secuencia de bases del ADN, a cada grupo de tres le corresponde un aminoácido, en ese orden. A cada grupo de tres bases en el ADN se le llama codón y existe al menos uno para cada uno de los veinte aminoácidos que usas tú. Parece sencillo, ¿eh?. Aunque seguro que te preguntarás “pero… ¿cómo pueden saber esto?” No te preocupes, yo ya lo he hecho. Lo hago continuamente. Y me han respondido.
Verás, fue George Gamow, físico teórico ucraniano quien, además de ser el padre de la teoría de la desintegración alfa vía efecto túnel, propuso que el número de bases para codificar un aminoácido debían de ser tres. Está claro: variaciones con repetición de cuatro elementos tomados de dos en dos solo hay 42, o sea 16. Los seres vivos usamos entre 20 y 22 aminoácidos, así que el número de combinaciones sería insuficiente para codificarlos. Sin embargo si las tomamos de tres en tres, serían 43, que es igual a 64, así que serían necesarias al menos tres bases.
Para precisar este dato, se diseñó un ingenioso experimento en el que se introducía una mutación en el gen T4 del ADN de un virus bacteriófago, el mutágeno usado insertaba o eliminaba una base del gen. Los genes mutados una o dos veces eran incapaces de generar proteínas, pero sí lo hacían cuando contenían tres mutaciones. Se le llamó el experimento Crick, Brenner, Barnett, Watts-Tobin y fue realizado en 1961 por el grupo de biólogos moleculares que le dio nombre. A propósito, este Crick es el mismo que ha aparecido antes por proponer la doble hélice.
Así que existen 64 combinaciones. Es a lo que se llama degeneración de los codones, pero tranquilo, no significa que los codones se abandonen desenfrenadamente a una abyecta parafilia, sólo quiere decir que hay más de un codón para cada aminoácido.Pero esa información codificada en tu ADN debe ser transportada hasta tu ribosoma, que es el que se encarga de sintetizar tus proteínas. Para eso necesitamos el ARN.
El ARN, o ácido ribonucleico, es muy parecido al ADN, pero en una prueba de agudeza visual encontrarías tres diferencias principales. Para empezar, el armazón del ARN está formado por ribosa, mientras que el ADN se sustenta en una cadena de moléculas de desoxirribosa, que es como una ribosa que, por esas cosas de la vida, ha perdido un átomo de oxígeno. Un detalle. Después verías una diferencia en las bases: en lugar de timina, como pareja de la actina, el ARN tiene el uracilo. Y por último, la más visible e importante, el ARN humano es lineal y de una hebra, eso le permite plegarse sobre sí mismo, creando enlaces entre bases de la misma hebra y así formar estructuras dentro de la célula como los ribosomas o la telomerasa, que se encarga de extender los sectores finales de los cromosomas, o telómeros. Aunque en algunos virus, el ARN puede formar una hélice doble y contener su código genético, así que ADN y ARN son bastante parecidos.
Todo este tinglado empieza a funcionar cuando la enzima ARN polimerasa, que va deslizándose por una de las patas de la cadena del ADN, abriéndolo como una cremallera, encuentra una secuencia específica que inicia la codificación de un gen, es decir, un promotor. Cuando termina la secuencia del promotor, esta enzima inicia la transcripción del código del ADN al ARN mensajero (ARNm). Hay bastantes tipos de ARN y el mensajero es una cadena lineal de ARN que contiene y transporta una copia de un gen hasta el ribosoma.
Otro tipo de ARN es el ARN de transferencia (ARNt), en realidad hay una molécula de ARNt para cada triplete de bases, o anticodón. Cada molécula de ARNt transporta el aminoácido correspondiente a su anticodón. Imagínatelos, flotando por el citogel y animados por la agitación térmica, una gran cantidad de ARNt, de todo tipo. El ARNm que ha viajado desde el núcleo hasta el ribosoma, se va deslizando y se va parando cada tres bases, o sea, cada codón. Cuando el anticodón del ARNt que pasaba por allí coincide con el codón del ARNm en el ribosoma, el ARNt se desprende del aminoácido que transporta, y, éste, se une a la cadena que está formando la proteína o cadena naciente, como la llaman los biólogos más románticos. Así que hasta que se termina la cadena de ARNm. Esto resulta un poco dificil de explicar, sin embargo es fácil de dibujar, así que te recomiendo que te sumerjas en la siguiente web (http://www.johnkyrk.com/DNAtranscription.esp.html) por instructiva y clarificadora.
Las proteínas pueden alcanzar una longitud considerable y su tamaño se mide en número de aminoácidos. Aunque también se tiene en cuenta su masa molecular que se expresa en Dalton o en kilodalton (kDa), siendo un Dalton equivalente a una unidad de masa atómica. Por ejemplo, las proteínas de la levadura tienen 466 aminoácidos y 53 kDa. Sin embargo, un componente muscular, la titina, tienen 27000 aminoácidos y 3000 kDa. Ya ves que tus ribosomas trabajan como chinos. Además, debido al plegado que sufren después de su formación, la proteínas pueden ser estructuras tridimensionales altamente complejas.
Nuestro código genético es como el código fuente del software, es una secuencia de sentencias en un lenguaje de programación que, una vez compilado, da lugar a un programa que realiza una serie de funciones. Si manejas algún lenguaje de programación, me entenderás. Yo soy muy mal programador y me cuesta varios intentos hasta que el compilador da por bueno mi código, porque es muy exquisito y, a la mínima, da la señal de “reparación o apoptosis” al programa porque su código es erróneo. Cuando consigo repararlo, la sintaxis es correcta, el programa se compila y parece funcionar y entonces llega el inevitable momento en que se queda colgado o no hace lo que yo quería que hiciera. El peor de los casos es que mi programa, dentro de ese trance, comienza a acaparar los recursos del sistema, se llena el disco duro y, al final, el PC se colapsa. Y si no eres programador, seguro que te has encontrado con en alguna situación similar manejando alguna aplicación que no nombraré para no tener problemas con Microsoft, pero comprenderás fácilmente el símil.
Con las proteínas pasa algo parecido, están codificadas en nuestros genes, pero son las que se ocupan de regular el funcionamiento de nuestras células y, al final, de nuestro organismo. Son responsables, entre otras cosas, del crecimiento y de la división celular. También son de origen proteico las señales que controlan la apoptosis o muerte celular programada, que es una especie de suicidio al que se someten voluntariosamente las células dañadas que no pueden ser reparadas, para evitar así daños mayores.
Pero ni todo el monte es orégano, ni todo el ADN está repleto de genes. Existen partes de tu ADN que no contienen genes, por tanto, no codifican proteínas. De hecho, en muchas especies solamente una pequeña parte del ADN contiene genes. Se estima que tienes unos 25000 genes esparcidos por tu ADN y que ocupan únicamente el 1.5% de tus 3000 millones de pares de bases. Estas partes de tu querida doble hélice se han llamado incluso ADN basura, al pensar que no tenía ninguna utilidad. En la actualidad se diferencia entre ADN codificante, que codifica proteínas, y no codificante, que no lo hace; la unión de ambos forma tu genoma. Los investigadores creen ahora que esta porción tan mayoritaria puede tener su papel importante en los mecanismos de regulación de la transcripción y la replicación del ADN, y están absolutamente seguros de que nos queda mucho por aprender del ADN no codificante.
Finalmente, también hay cambios en el ADN que no afectan a la secuencia, es decir, al genoma, pero que sí afectan a la actividad genética. ¿Cómo puede ser esto? Porque hay compuesto químicos que se adhieren a un gen para regular su actividad, estas modificaciones se llaman cambios epigenéticos. Todos los compuestos a que se han añadido a tu genoma para regular la actividad (expresión) de tus genes forman tu epigenoma. El epigenoma permanece en una célula que se divide y, en algunos casos, pueden ser heredados generación tras generación. Además, se ha demostrado que tu epigenoma es sensible a las influencias externas como la dieta o los contaminantes. El genoma no varía para las distintas células de tu cuerpo, el epigenoma si lo hace. Las proteínas del crecimiento óseo son producidas en tus huesos y no en tus músculos, por suerte. Si escuchas a los que zancochean con genes, oirás que hablan de genes que están metilados. Pues la metilación es una forma de silenciar un gen, simplemente añadiéndole grupos metilo a un segmento del DNA, la proteína asociada ya no se expresa.
Ya sé que el último párrafo lo he empezado con la palabra «finalmente», pero tengo que darte un disgusto. Tu epigenoma todavía da más de sí. Las proteínas estructurales que dan consistencia a la cromatina pueden estar detrás de otra característica muy curiosa del núcleo, el comportamiento topológico del núcleo. O sea, que la actividad de un gen depende de todo lo que hemos dicho hasta ahora y, además, de su localización física dentro del núcleo. Todo comenzó gracias a la portentosa intuición de Theodor Boveri, embriólogo alemán, que propuso, ya en 1900, que el origen de un tumor era una sola célula cancerosa. Propuso también, entre otras cosas, la existencia de territorios cromosómicos donde se veían confinadas las fibras de ADN cuando se pasaba de cromosomas a cromatina, frente a lo que se ha aceptado hasta hace poco, que las fibras se entremezclaban en un desorden total, también llamado «spaghetti model». Tuvieron que pasar 80 años para que nuestros microscopios fueran capaces de revelar este curioso comportamiento.
Los colegas actuales de Theodor han conseguido demostrar que cada cromosoma, una vez pasa a formar parte de la cromatina, tiene un asiento asignado en el núcleo, tiene «territorio cromosómico». Lo han conseguido gracias a sofisticadas técnicas de marcación fluorescente, que les permiten activar la fluorescencia de cada cromosoma por separado. Deben de utilizar un láser tremendamente colimado. Pero esto no es cierto en general, las células embrionarias carecen de esos territorios y, como verás, la explicación es muy simple.
Algo que ya se sabía desde los años 30 es que, en las zonas periféricas del núcleo, existe un tipo de cromatina superdensa, llamada heterocromatina. Lo que se ha descubierto hace poco es que la actividad de los genes es mucho menor en esas áreas de alta densidad. Algunas proteínas que funcionan como aglomerantes del ADN, son los acomodadores epigenéticos, y, dependiendo la función que debe realizar cada célula, buscan la butaca más conveniente para cada cromosoma. La parte central del núcleo queda más libre, favoreciendo la actividad de los factores de transcripción, la ARN polimerasa (que suelen ser moléculas bastante tochas) y de los genes cercanos. Las células germinales y embrionarias necesitan explotar todo su potencial genético, es por esto que carecen de territorios silenciados y de heterocromatina. Así que en células diferenciadas, encontraremos una parte central del núcleo donde se promoverá la activación de los genes y una periferia donde se silenciará. Y tendrán sus territorios cromosómicos en las localizaciones correspondientes a su idiosincrasia celular. Además, el ADN que se encuentre en su forma densa, será poco accesible y estará mucho más protegido frente a las agresiones.

Territorios cromosómicos en un fibroblasto humano, marcados mediante la técnica de fluorescencia de hibridación in situ, (cromosomas del 1 al 22 +X + Y)
Esta pequeña maravilla, que es la célula, dedica grandes esfuerzos a proteger la integridad de nuestra información genética. Para que una célula entre en un bucle reproductivo sin fin, tienen que eliminarse varios puntos de control del ciclo celular y varias barreras en el funcionamiento de la célula. Nuestras células pueden tener silenciadas alguna de esas barreras, por ejemplo: estirpes celulares que en estado normal proliferan, como las de la piel, partirían con ventaja en esta carrera, de ahí que existan tejidos que, por su naturaleza, sean más sensibles que otros.
También aumentan el riesgo de sufrir un proceso de este tipo las células con mutaciones hereditarias que no producen ningún efecto por sí solas, pero que sí lo hacen asociadas a otras mutaciones con otro origen. El retinoblastoma hereditario se manifiesta en niños y casi siempre en los dos ojos, se trata de individuos con una única copia defectuosa del gen RB en el cromosoma 13. El evento esencial es la mutación del gen RB normal en una de las células que le impide producir proteína Rb funcional. Lo curioso es que el retinoblastoma esporádico se da en individuos de avanzada edad y solamente en un ojo. Si el retinoblastoma se extirpa antes de que alcance la malignidad, estos niños, a menudo, sobreviven hasta la madurez y tienen hijos, que a su vez podrían heredar el cromosoma RB defectuoso. Cara o cruz. Muchos tumores humanos, como este caso, manifiestan una predisposición debida a una mutación hereditaria, aunque el desencadenante sea otra mutación no heredada (somática).
Las mutaciones en los genes BRCA1 y BRCA2 (Breast Cancer Susceptibility Gen) son un ejemplo paradigmático popularizado recientemente por Angelina Jolie. Según Harvey Lodish en su libro Molecular Cell Biology, las mujeres que heredan un alelo mutante de BRCA1, que es un gen supresor del crecimiento tumoral, tienen un 60% de probabilidad de desarrollar cáncer de mama antes de los 50 años, frente a un 2% las que no. Sin embargo el BRCA1 no está mutado en el cáncer de mama no hereditario. Todos estos efectos suelen tener un origen multifactorial (genética, estilo de vida, factores ambientales…) y que estemos cada vez más cerca de comprenderlos me resulta tan asombroso como complicado.
En general, queda mucho por investigar en genética, pero los pocos hallazgos que se han conseguido nos han demostrado que avanzar en el conocimiento del funcionamiento de los genes supondrá una tarea costosa en todos los sentidos, pero también será como descubrir la clave de cifrado de un mensaje. Nos permitirá, literalmente, curar las enfermedades al solucionar directamente la fuente del problema. Conoceremos de primera mano dónde es vulnerable la enfermedad y podremos “unipersonalizar” los tratamientos, jugaremos con las cartas marcadas. Hoy ya somos capaces, entre otros logros, de diagnosticar desórdenes genéticos en un feto analizando el líquido amniótico e incluso seleccionar un embrión que esté libre de una mutación que, en condiciones normales, hubiera heredado de sus progenitores. Todo esto parece ciencia ficción, incluso puede que lo sea, aun así, es una de las grandes esperanzas de la medicina, pero eso habría que discutirlo en otro post.

Alba fue una coneja a la que se le implantó un el gen de la proteína verde fluorescente (GFP) que se encuentra en alguna medusas. Bajo la luz azul, Alba se iluminaba.


![TablaCodonesVsAminoacidos[1]](http://bnnas.files.wordpress.com/2014/07/tablacodonesvsaminoacidos1.jpg)