¿Qué tiene un protón que no tengan los fotones? (2 de 2)
Sumario:
Como decíamos ayer…. Bueno, afortunadamente aún no me persigue la Inquisición por mis opiniones, ni he estado encarcelado por traducir libros políticamente incorrectos. Ni siquiera he interrumpido cinco años el tema que tenía entre manos como le ocurrió a Fray Luis de León, pero no me negaréis que la frase del Agustino de Cuenca viene […]
Como decíamos ayer…. Bueno, afortunadamente aún no me persigue la Inquisición por mis opiniones, ni he estado encarcelado por traducir libros políticamente incorrectos. Ni siquiera he interrumpido cinco años el tema que tenía entre manos como le ocurrió a Fray Luis de León, pero no me negaréis que la frase del Agustino de Cuenca viene que ni pintada.
Pues bien, como decíamos ayer, las características físicas de los protones hacen que estos tratamientos presenten unas peculiaridades que los hacen especialmente apropiados para determinadas patologías. De forma general, las ventajas clínicas de la protonterapia frente a la terapia convencional con fotones se pueden resumir en dos aspectos fundamentales: por un lado, un mejor control local del tumor como consecuencia de la posibilidad de aumentar la dosis en el volumen blanco. Esto, a su vez, trae consigo un aumento de la tasa de supervivencia libre de enfermedad. Y por otro lado, aunque muy relacionado con lo anterior, la reducción en incidencia de efectos secundarios debido a la disminución de la dosis en los tejidos sanos adyacentes.
Un poco de Radiobiología
Son estas propiedades físicas las que confieren sus diferencias fundamentales ya que, si consideramos el impacto biológico de los protones, medido en términos de Eficacia Biológica Relativa (RBE en sus siglas en inglés), podemos llevarnos la sorpresa de que los protones parece que son (se sigue investigando en este aspecto) apenas un poco más efectivos, radiobiológicamente hablando, que los fotones. Atendiendo a la definición de RBE, que no es más que la razón entre la dosis necesaria para producir un determinado efecto, liberada por una radiación de referencia (habitualmente Co-60), y por un haz de una calidad determinada, encontramos que la Eficacia Biológica Relativa de los protones es, aproximadamente, 1.1, es decir, un haz de protones es “únicamente” un 10% más efectivo que uno de fotones. Pero vamos a verle a esto el lado bueno: en el caso que se instalase un centro de protonterapia en el que no se tuviese práctica previa con estos tratamientos, la curva de aprendizaje sería muy rápida, ya que se podría extrapolar con bastante fiabilidad la experiencia clínica adquirida previamente con la radioterapia convencional con fotones. En otras palabras, la información contenida en un mapa de distribución de dosis absorbida o en un histograma dosis-volumen de un tratamiento con protones sería comparable muy aproximadamente, desde una perspectiva clínica, al de un tratamiento similar realizado con fotones.
Este valor de la RBE contrasta con la de un haz de Carbono que es del orden de 2.5-3. No obstante, a pesar de la simplicidad del concepto de la RBE, su aplicación clínica es compleja ya que depende del tipo de partícula, de su energía, de la dosis, de la dosis por fracción, del número de sesiones, del tipo de célula o tejido y varía si consideramos efectos agudos o crónicos. Para continuar con lo que comentaba en el párrafo anterior, la relativamente baja transferencia lineal de energía (LET) de los protones permite asignarles un factor constante (RBE = 1.1) en todo el campo de tratamiento. En cambio, en el caso de iones más pesados, las variaciones de LET son tremendamente importantes, de forma que la RBE varía de forma considerable dentro del volumen blanco. Esto implica que la distribución de dosis absorbida no está asociada de la misma forma que en un haz de fotones al daño celular que, a fin de cuentas, es el factor más importante desde el punto de vista terapéutico. Así pues, esta variación de la eficacia biológica ha de ser considerado cuidadosamente y supone un reto muy importante en lo que concierne a la planificación del tratamiento y a su correcta administración.
Indicaciones clínicas
Puestos a dar el paso a la terapia con partículas, me viene a la cabeza la imagen del político de turno sosteniendo la calavera y haciéndose la famosa pregunta que se hacía el príncipe Hamlet, contextualizada adecuadamente: “To ion or not to ion. That is the (first) question”. En Román Paladino, ¿vamos a iones o vamos a protones?
Si finalmente España da el paso -cruzo los dedos- para instalar un centro de estas características, sería mucho más razonable, en mi opinión, comenzar con protones. No sólo por cuestiones económicas, pese a ser éste un factor tremendamente importante en los tiempos que corren, sino por las dificultades asociadas a la terapia con iones, que pasan no sólo por cuestiones técnicas, sino por la experiencia clínica previa necesaria para obtener resultados óptimos de una inversión de estas dimensiones.
A pesar de las mejoras objetivas que pueden obtenerse con este tipo de tratamientos, resultaría inadecuado pretender que la radioterapia convencional se vería mayoritariamente desplazada por los protones.
Para tener una idea del número potencial de pacientes que se podrían beneficiar de la protonterapia y la «rentabilidad» de una instalación de este tipo, la solución no es emular a Hamlet y preguntar a la calavera. Lo más inteligente es encargar a un grupo de expertos que evalúen todos los factores que entran en juego en una decisión de este tipo. El Ministerio de Sanidad holandés encargó hace poco a un grupo de profesionales cualificados un estudio de este tipo y, entre sus conclusiones más relevantes, yo destacaría la clasificación de las indicaciones de la terapia con protones y su incidencia en el número total de pacientes subsidiarios de Radioterapia.
Esta clasificación establece cuatro grupos atendiendo a la «evidencia» de su aplicación. El primer grupo lo constituye el conjunto de pacientes en los que la indicación de la protonterapia no está cuestionada ni siquiera por los más recalcitrantes defensores de la necesidad de estudios aleatorios comparativos previos a su utilización. En este grupo se incluyen los tumores oculares, gran parte de los cerebrales, los de base de cráneo y los pediátricos. En total, constituyen únicamente un 0.6% de los casos posibles de Radioterapia pero, aún así, supondrían en España unos 700 pacientes nuevos por año, número más que suficiente para completar una máquina funcionando a doble turno y a velocidad de crucero. El segundo y el tercer grupo tienen en común que, si se llevaran a cabo estudios clínicos aleatorios (lo cual es más que discutible por lo que se expone en el siguiente apartado), se obtendrían resultados concluyentes en unos cinco años. Uno de estos grupos incluye los casos que mejorarían el control local de la enfermedad al permitir una escalada de la dosis. Entre ellos se incluyen los sarcomas, cabeza y cuello y pulmón (células grandes) y suponen aproximadamente el 3% del total. El otro grupo, con igual plazo para la obtención de evidencias, lo constituyen los casos en los que el beneficio de la reducción de efectos secundarios puede ser fundamental. Este grupo lo constituyen los tumores intracraneales, cabeza y cuello, pulmón, sarcomas, linfomas, genitourinarios y gastrointestinales, entre otros. Su incidencia supone el 12.1% del total. Por último está el grupo en el que la incidencia de segundos tumores radioinducidos presenta una probabilidad significativa. Para obtener evidencias en este caso, se necesitarían estudios aleatorios que abarcarían un periodo no inferior a quince años. Se encuentran entre ellos algunos tumores de mama, testiculares y linfomas. En total suponen el 2% del total de los casos subsidiarios de radioterapia.
Si atendemos a esta clasificación, en el peor de los casos (o mejor, según se mire) tendríamos que únicamente un 17.7% del total de los casos tendrían justificado el uso de protones, pero esto pone de relieve la importancia de un comité que evalúe y que establezca protocolos acerca de la idoneidad de su uso en cada caso particular.
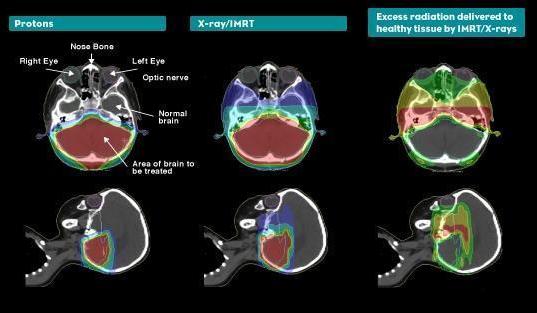
Pero hagamos una mención especial al impacto en los tumores pediátricos. A pesar de que, afortunadamente, no son muy frecuentes (alrededor del 2% del número total de casos nuevos de cáncer diagnosticados al año), constituyen la segunda causa de muerte para los críos entre 5 y 14 años. En los casos en que resulta necesaria la aplicación de radioterapia, hay que valorar el daño potencial que suponen los tratamientos con fotones que van, dependiendo de la localización, desde trastornos del crecimiento, hasta discapacidad mental, pasando por esterilidad o inducción de segundos tumores. Y es que no hay que olvidar que los niños no son adultos pequeñitos. Si esto fuese así, no existirían los pediatras, bastaría con médicos bajitos. La proliferación celular es mucho mayor en los chavales y este hecho se vuelve en nuestra contra cuando se irradia tejido sano. Por ejemplo, su materia blanca cerebral es extremadamente sensible y pueden producirse trastornos cognitivos incluso a dosis relativamente bajas. Por lo tanto, es evidente que el “precio de curar” es un asunto muy serio en oncología pediátrica. Y en este contexto, ¿cuál es el papel de la protonterapia? De forma resumida, primero poder escalar dosis en tumores radio (quimio) resistentes y segundo, pero no por ello menos importante, mejorar la calidad de vida de los pacientes en la mayor parte de los casos, lo que va asociado a la mejor salvaguarda del tejido sano implicado. Esta reducción del volumen sano irradiado conseguida con la protonterapia puede apreciarse con claridad en el ejemplo de la figura, donde se han diseñado dos tratamientos equivalentes desde el punto de vista del control de la enfermedad. El exceso de dosis en tejido sano que se produce con una estrategia relativamente sofisticada empleando fotones, comparado con la opción de la protonterapia, podría justificar muchos efectos secundarios asociados al tratamiento.

Comparación de un tratamiento con protones y otro con IMRT en un caso de tumor cerebral pediátrico. Las figuras de la derecha representan el exceso de dosis liberada a tejido sano con el tratamiento con fotones (Fuente: ProCure Training and Development Center)
Y sin especular desde el punto de vista teórico, sino mostrando resultados con pacientes pediátricos de carne y hueso, el beneficio de este tipo de tratamientos se pone de manifiesto con los datos publicados por Miralbell, a partir de la experiencia en el PSI (Villigen, Suiza), en los que se cuantifica el riesgo de inducción de segundos tumores tras un tratamiento con Radioterapia para dos tipos de tumores infantiles.

Riesgo relativo (normalizado para el caso de terapia conformada con fotones) de inducción de segundos tumores tras tratamiento con fotones, intensidad modulada con fotones, protones e intensidad modulada con protones (Miralbell et al. IJROBP-2002; 54: 824-829)
¿Por qué no está más extendido su uso?
Hay una razón de bastante peso que podría justificar la escasa implantación de unidades de protonterapia y es su precio, a pesar de que los avances tecnológicos han conseguido en los últimos años reducir considerablemente este factor. Para dar una idea de esta reducción quizás sea significativo señalar que, en la actualidad, el coste de una instalación de estas características es comparable a lo que gasta en fármacos en un solo año un Servicio de Oncología Médica que atienda un área sanitaria importante en España. Pero también hay voces que arguyen que deberían realizarse estudios clínicos aleatorios, en los que se compare la protonterapia con la radioterapia convencional con fotones, antes de que su uso se haga más extensivo. Sin embargo, este argumento es difícilmente justificable ya que la distribución de dosis es, virtualmente en todos los casos, superior cuando se usan protones. Si además, como sabemos, la eficacia biológica de ambos es prácticamente equivalente y, además, la radiación suministrada a los tejidos sanos los daña de forma creciente con la dosis recibida, es difícil no sacar la conclusión de que la terapia con protones será, en casi todos los casos, superior a la convencional y explica por qué los profesionales que tienen a su disposición ambas herramientas consideran éticamente inaceptable realizar ensayos clínicos de comparación.
No obstante, a pesar del coste que implica una instalación de estas características, aunque se esté extendiendo la utilización nuevas y sofisticadas técnicas que han mejorado significativamente la terapia con fotones (IMRT-IGRT) y pese a no existir estudios aleatorios comparativos, el aumento del número de centros que ofrecen terapia con protones y, consecuentemente, el número de pacientes tratados no para de crecer. Por algo será.

Centros de protonterapia o terapia con iones en el mundo (puntos azules en la imagen). Se muestra también en gráfica superpuesta el crecimiento anual de centros (curva azul) y de pacientes (curva roja)
Conclusiones
Mi objetivo es que, al terminar de leer este post, os haya quedado claro cuáles son las ventajas de la terapia con protones y que en este momento, se dan en nuestro país las condiciones adecuadas para poder obtener una elevada rentabilidad sanitaria de este tipo de tratamientos. Sería absurdo pensar en una inversión de estas dimensiones en materia de salud en un país donde se salvarían más vidas con un programa de vacunación reglado o con una red de alcantarillado adecuado. Pero en España, la situación de desarrollo económico conseguida en los últimos treinta años -si no la arruinan antes nuestros gobernantes – exige pasos cualitativos de este tipo que, con toda seguridad, se verán reforzados por el hecho de que se ha obtenido la masa crítica de profesionales con la formación adecuada para afrontar con éxito un reto de estas características. En este tiempo, los avances conseguidos por la radioterapia han sido espectaculares y es muy importante recalcar que este logro necesita, cada vez en mayor medida y en especial en la terapia con protones, la estrecha colaboración de profesionales pertenecientes a campos tan distintos como la oncología radioterápica, la física médica, la radiobiología, la física de radiaciones o la ingeniería de dinámica de haces.
Ojalá que este post, además de cumplir con su función de aportar una cierta «culturilla» a los lectores de Desayuno con Fotones, caiga en manos de alguien con responsabilidad -y estoy empleando esta palabra con toda la intención, para aprovechar todas sus acepciones- y podamos ofrecer a nuestros pacientes una radioterapia con toda la calidad que se merecen.







